Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.
Откуда появилась великая таблица Мендлеева?
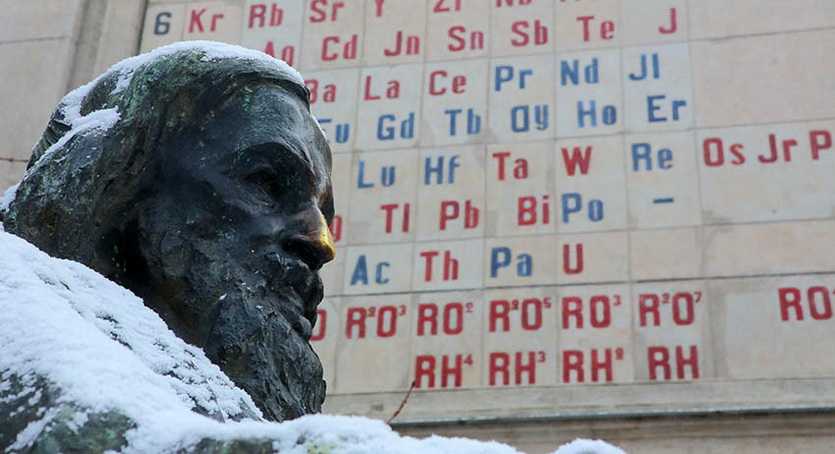 Памятники Менделееву существуют во всех странах мира
Памятники Менделееву существуют во всех странах мира
К моменту появления периодической таблицы в 1869 году было открыто 63 химических элемента. Все они представлялись в виде хаотического набора, хотя попытки какого-то упорядочения совершались регулярно.
Первой известной публикацией на этот счет стал «закон триад» (1829 год) Иоганна Дёберейнера, однако он дальше понимания связи атомной массы и химических свойств элементов не продвинулся.
Позднее Александр Эмиль Шанкуртуа создал «Теллуров винт» (1862), разместив элементы на винтовой линии. Ему удалось увидеть частое циклическое повторение химических свойств по вертикали.
Самой правдоподобной стала система Юлиуса Лотара Мейера (1864), который смог составить таблицу, упорядочив элементы по свойствам и весам. Увы, он взял за основу периодичности свойств валентность, что оказалось ошибкой.
 Главный конкурент, который подсказал идею: Лотар Мейер
Главный конкурент, который подсказал идею: Лотар Мейер
Менделеев, по собственным словам, занимался проблемой систематизации химических элементов на протяжении 20 лет (а не спонтанно во время сна, вопреки устоявшемуся мнению), перекладывая карточки с названием и свойствами элементов в поиске нужной комбинации.
И в 1869 ему удалось найти ответ, опубликованный в статье журнала Русского химического общества «Соотношение свойств с атомным весом элементов».
 Периодическая таблица Мейера довольно скудна
Периодическая таблица Мейера довольно скудна
Чуть позже идею подхватил Мейер, опубликовав собственную работу с аналогичным результатом. Знал ли он о достижении Менделеева? Незивестно. К тому же он смог организовать лишь 28 элементов
Однако, из-за него в Европе и США Периодическая таблица Менделеева не имеет в названии имени собственного.
Тем не менее, мировое сообщество ученых трижды выдвигало Менделеева лауреатом Нобелевской премии. Увы, ему не удалось стать членом Российской академии наук, а её члены раз за разом отвергали кандидатуру.
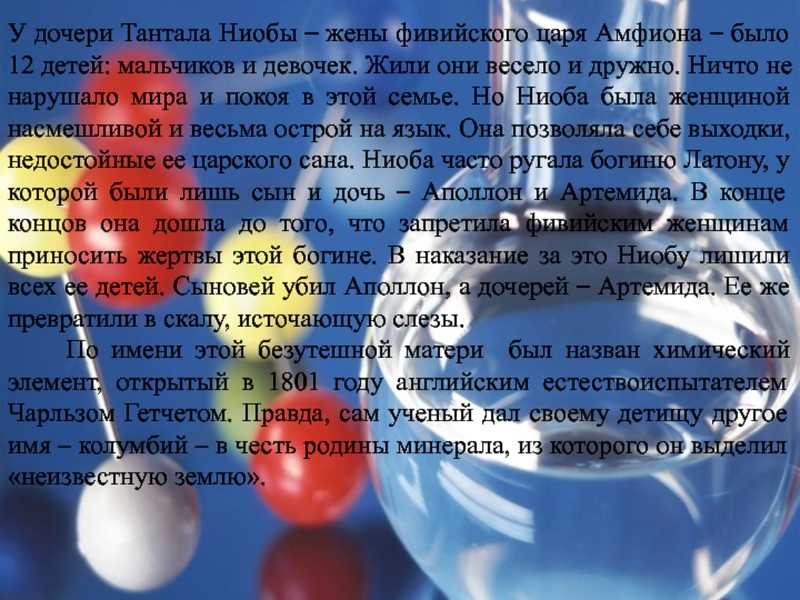
Слайд 9У дочери Тантала Ниобы – жены фивийского царя Амфиона –
было 12 детей: мальчиков и девочек. Жили они весело и
дружно. Ничто не нарушало мира и покоя в этой семье. Но Ниоба была женщиной насмешливой и весьма острой на язык. Она позволяла себе выходки, недостойные ее царского сана. Ниоба часто ругала богиню Латону, у которой были лишь сын и дочь – Аполлон и Артемида. В конце концов она дошла до того, что запретила фивийским женщинам приносить жертвы этой богине. В наказание за это Ниобу лишили всех ее детей. Сыновей убил Аполлон, а дочерей – Артемида. Ее же превратили в скалу, источающую слезы. По имени этой безутешной матери был назван химический элемент, открытый в 1801 году английским естествоиспытателем Чарльзом Гетчетом. Правда, сам ученый дал своему детищу другое имя – колумбий – в честь родины минерала, из которого он выделил «неизвестную землю».
Слайд 4 Исследуя песок, найденный близ местечка Менакин на побережье Корнуэлла,
англичанин Вильям Грегор открыл в 1789 году неизвестную землю, получившую
название менакит. Через шесть лет немецкому химику Мартину Клапроту удалось доказать, что минерал рутил – аналог менакина – представляет собой оксид неизвестного металла. Вскоре после этого оба ученые выделили из своих образцов препараты, которые по свойствам оказались весьма похожими друг на друга. Вывод был однозначным: открыт новый элемент. По предложению Клапрота, он получил гордое, ко многому обязывающее имя – титан. Существует несколько версий о происхождении этого названия. Одна из них берет истоки в греческой мифологии. Титанами называли могучих и храбрых детей бога Неба Урана и богини Земли Геи, не боявшихся вступать в борьбу с громовержцем Зевсом. Однако есть и другое мнение. Новый элемент был наречен в честь богини германской мифологии предводительницы веселых эльфов Титании. Вполне возможно, что Мартин Клапрот – имел в виду именно ее, когда выбирал имя своему детищу. В чистом виде титан удалось получить только в 1910 году.

Слайд 7В начале 19 века в разных районах Швеции были построены
доменные печи, перерабатывавшие местное сырье. Но странное дело: из одних
руд получался хороший чугун, из него вырабатывались прекрасные сорта стали, из другого же – необычайно хрупкие. Почему? Проверкой химического состава сырья занялся молодой ученый Нильс Сефстрем. После долгих кропотливых опытов ему удалось выделить из руды горы Таберг черный порошок. Дальнейшие исследования показали, это неизвестный металл. Новый металл был назван ванадием – по имени древнескандинавской богини любви, чувства которой отличались необыкновенным постоянством. На русском языке название «ванадий» было введено в употребление Г. И. Гессом. Минерал, из которого был получен ванадий, был назван «ванадинит» и был обнаружен в разных частях Земли. В 1869 году Г. Роско сумел приготовить металлический ванадий.

История открытия Периодического закона.
К середине XIX века были открыты 63 химических элемента, и попытки найти закономерности в этом наборе предпринимались неоднократно.
В 1829 году Дёберейнер опубликовал найденный им «закон триад»: атомный вес многих элементов близок к среднему арифметическому двух других элементов, близких к исходному по химическим свойствам (стронций, кальций и барий; хлор, бром и йод и др.). Первую попытку расположить элементы в порядке возрастания атомных весов предпринял Александр Эмиль Шанкуртуа (1862), который разместил элементы вдоль винтовой линии и отметил частое циклическое повторение химических свойств по вертикали. Обе указанные модели не привлекли внимания научной общественности.
В 1866 году свой вариант периодической системы предложил химик и музыкант Джон Александр Ньюлендс, модель которого («закон октав») внешне немного напоминала менделеевскую, но была скомпрометирована настойчивыми попытками автора найти в таблице мистическую музыкальную гармонию. В этом же десятилетии появились ещё несколько попыток систематизации химических элементов; ближе всего к окончательному варианту подошёл Юлиус Лотар Мейер (1864). Д. И. Менделеев опубликовал свою первую схему периодической таблицы в 1869 году в статье «Соотношение свойств с атомным весом элементов» (в журнале Русского химического общества); ещё ранее (февраль 1869 г.) научное извещение об открытии было им разослано ведущим химикам мира.
По легенде, мысль о системе химических элементов пришла к Менделееву во сне, однако известно, что однажды на вопрос, как он открыл периодическую систему, учёный ответил: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово».
Написав на карточках основные свойства каждого элемента (их в то время было известно 63, из которых один — дидим Di — оказался в дальнейшем смесью двух вновь открытых элементов празеодима и неодима), Менделеев начинает многократно переставлять эти карточки, составлять из них ряды сходных по свойствам элементов, сопоставлять ряды один с другим. Итогом работы стал отправленный в 1869 году в научные учреждения России и других стран первый вариант системы («Опыт системы элементов, основанной на их атомном весе и химическом сходстве»), в котором элементы были расставлены по девятнадцати горизонтальным рядам (рядам сходных элементов, ставших прообразами групп современной системы) и по шести вертикальным столбцам (прообразам будущих периодов). В 1870 году Менделеев в «Основах химии» публикует второй вариант системы («Естественную систему элементов»), имеющий более привычный нам вид: горизонтальные столбцы элементов-аналогов превратились в восемь вертикально расположенных групп; шесть вертикальных столбцов первого варианта превратились в периоды, начинавшиеся щелочным металлом и заканчивающиеся галогеном. Каждый период был разбит на два ряда; элементы разных вошедших в группу рядов образовали подгруппы.
Сущность открытия Менделеева заключалась в том, что с ростом атомной массы химических элементов их свойства меняются не монотонно, а периодически. После определённого количества разных по свойствам элементов, расположенных по возрастанию атомного веса, свойства начинают повторяться. Например, натрий похож на калий, фтор похож на хлор, а золото похоже на серебро и медь. Разумеется, свойства не повторяются в точности, к ним добавляются и изменения. Отличием работы Менделеева от работ его предшественников было то, что основ для классификации элементов у Менделеева была не одна, а две — атомная масса и химическое сходство. Для того, чтобы периодичность полностью соблюдалась, Менделеевым были предприняты очень смелые шаги: он исправил атомные массы некоторых элементов (например, бериллия, индия, урана, тория, церия, титана, иттрия), несколько элементов разместил в своей системе вопреки принятым в то время представлениям об их сходстве с другими (например, таллий, считавшийся щелочным металлом, он поместил в третью группу согласно его фактической максимальной валентности), оставил в таблице пустые клетки, где должны были разместиться пока не открытые элементы. В 1871 году на основе этих работ Менделеев сформулировал Периодический закон, форма которого со временем была несколько усовершенствована.
Научная достоверность Периодического закона получила подтверждение очень скоро: в 1875—1886 годах были открыты галлий (экаалюминий), скандий (экабор) и германий (экасилиций), для которых Менделеев, пользуясь периодической системой, предсказал не только возможность их существования, но и, с поразительной точностью, целый ряд физических и химических свойств.
Химический элемент — что это за понятие
Англо-ирландский химик, физик, натурфилософ и богослов Роберт Бойль на страницах своей книги «Химик-скептик» дал определение химического элемента: это вещества, которые имеют в своем составе однородные корпускулы (первоматерия), на которые могут разлагаться. Эти корпускулы часто имеют разный размер и форму, однако те, из которых состоят тела, стабильны при любом их превращении.
А.Л. Лавуазье в своем труде «Элементарный курс химии» (1789 г.) опубликовал список химических элементов, разделив их на типы. Он первым приравнял некоторые простые вещества к химическим элементам, например, кислород, азот, водород, уголь, фосфор, а также металлы.
Д
Дальтон привлек внимание ученых XIX века своей атомно-молекулярной гипотезой. В ней химический элемент был представлен отдельным видом атомов, имеющим свой вес, который определял собственную химическую природу вещества
Современное определение звучит так.
Когда был открыт Периодический закон (1869 г.), насчитывалось 63 элемента с известным атомным весом и образуемыми веществами. В понятии Д.И. Менделеева это материальные составляющие простых (сложных) тел, придающие им определенные физические и химические свойства. Именно открытие Менделеева послужило толчком для прогнозирования существования ряда элементов, а также легло в основу классификации.
Химические элементы распространены в природе крайне неравномерно. Так, если водород присутствует во Вселенной в количестве 92% от всех атомов, то гелий — в 7,9%.
Земная кора в максимальных количествах содержит кислород (более 49%), кремний, алюминий и железо.
Желание выстроить известные химические элементы в ряд было не только у Менделеева. Наиболее интересными были следующие варианты:
- Триады Деберейнера. Немецкий химик попытался объединить сходные по свойствам элементы в группы, включающие по три представителя. Таким группам было дано название триады. Каждая из них имела серединный представитель, масса которого была средним арифметическим. Пример: литий, натрий, калий.
- Спираль Шанкуртуа. Французский ученый расположил известные тогда элементы в порядке увеличения их атомных масс. Полученный ряд поместил на поверхности цилиндра, создав так называемую земную спираль.
Если такую земную спираль развернуть, на вертикальных линиях, будут находиться химические элементы с похожими свойствами. Например, на одной вертикали находились:
- литий, натрий, калий;
- бериллий, магний, кальций;
- кислород, сера, теллур.
- Октавы Ньюлендса. Когда англичанин Дж.А. Ньюлендс выстроил известные химические элементы в порядке увеличения их атомных масс, он понял, что каждый восьмой элемент своими свойствами похож на первый. Он назвал это явление законом октав. Это была еще одна попытка группировки по семь элементов.
Существовали еще попытки классифицировать химические элементы, например, таблица Мейера, состоящая из 28 представителей, которые были построены в 6 столбиков, зависимо от их валентности.
Изучаем значение и обозначение цветов элементов Менделеева в таблице
В таблице Менделеева каждый химический элемент представлен своим собственным цветом. Цветовая пометка элементов упрощает визуальное восприятие и помогает запомнить информацию о них. Значение цветов элементов Менделеева связано с их химическими свойствами, электронной структурой и положением в таблице.
Обозначение цветов элементов Менделеева используется для облегчения чтения таблицы и ориентации в ней. Каждый цвет соответствует определенной группе элементов, которые имеют сходные химические свойства или общий химический род. Так, например, цветом синего были помечены легкие металлы, а зеленым — благородные газы.
Изучая значение и обозначение цветов элементов Менделеева в таблице, вы сможете легко идентифицировать элементы и узнать их свойства. Запомните основные цветовые пометки и обозначения, и вы сможете легко переходить от одного элемента к другому и быстро находить нужную информацию.
Важно помнить, что цветовая пометка элементов Менделеева может немного различаться в разных таблицах. Однако, общие принципы цветовой классификации элементов остаются неизменными и позволяют упростить изучение периодической таблицы
Слайд 6В Мексике, близ селения Цимапан, были найдены залежи свинцовой руды,
и в 1801 году образец ее попал в руки профессора
минералогии из Мехико А. Дель Рио. Исследователь, будучи неплохим аналитиком, изучил образец и пришел к выводу, что в нем содержится новый металл, похожий на хром и уран. Затем А. Дель Рио получил несколько соединений металла – каждое было окрашено по – своему. Поразившись этому обстоятельству, ученый предложил для нового элемента название «панхромий» (от греческого слова, означающего «окрашенный в разные цвета»), но вскоре изменил его на другое – «эритроний» (соответствующее греческое слово значит «окрашенный в красный цвет»). Причиной послужило то, что многие соли нового элемента приобретали при нагревании красную окраску. Имя А. Дель Рио было малоизвестно европейским химикам, и услышав о его результатах, они отнеслись к ним с сомнением.

Длиннопериодная форма таблицы Менделеева
Именно нечто подобное и было создано Дмитрием Ивановичем Менделеевым. Именно такой вариант таблицы наиболее наглядно иллюстрирует периодический закон. К сожалению, у длиннопериодной формы есть один недостаток: таблица занимает слишком много места. Именно поэтому многие отдают предпочтение короткопериодной форме.
|   | IA | IIA | IIIB |   | IVB | VB | VIB | VIIB |   VIIIB | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |||||||||||||||
| 1 | 1 H |   | 1H | 2He | ||||||||||||||||||||||||||||
| 2 | 3Li | 4Be |   | 5B | 6C | 7N | |
9F | 10Ne | |||||||||||||||||||||||
| 3 | 11Na | 12Mg |   | 13Al | 14Si | 15P | 16S | 17Cl | 18Ar | |||||||||||||||||||||||
| 4 | 19K | 20Ca | 21Sc |   | 22Ti | 23V | 24Cr | 25Mn | 26Fe | 27Co | 28Ni | 29Cu | 30Zn | 31Ga | 32Ge | 33As | 34Se | 35Br | 36Kr | |||||||||||||
| 5 | 37Rb | 38Sr | 39Y |   | 40Zr | 41Nb | 42Mo | 43Tc | 44Ru | 45Rh | 46Pd | 47Ag | 48Cd | 49In | 50Sn | 51Sb | 52Te | 53I | 54Xe | |||||||||||||
| 6 | 55Cs | 56Ba | 57La | 58Ce | 59Pr | 60Nd | 61Pm | 62Sm | 63Eu | 64Gd | 65Tb | 66Dy | 67Ho | 68Er | 69Tm | 70Yb | 71Lu | 72Hf | 73Ta | 74W | 75Re | 76Os | 77Ir | 78Pt | 79Au | 80Hg | 81Tl | 82Pb | 83Bi | 84Po | 85At | 86Rn |
| 7 | 87Fr | 88Ra | 89Ac | 90Th | 91Pa | 92U | 93Np | 94Pu | 95Am | 96Cm | 97Bk | 98Cf | 99Es | 100Fm | 101Md | 102No | 103Lr | 104Ku | 105Ns | 106 | 107 | 108 | 109 | 110 | 111 | 112 | 113 | 114 | 115 | 116 | 117 | 118 |
 А>
А>
Слайд 12Когда заходит речь об элементе № 73, вспоминается греческая легенда
о фригийском царе Тантале – любимом сыне громовержца Зевса. Однажды
он пригласил богов к себе на пиршество и угостил блюдом, приготовленным из плоти собственного ребенка. Тантал хотел убедиться в их хваленом всезнании… Дорого обошлось ему это святотатство. Разгневанные боги придумали Танталу жестокое наказание. Его заточили в пруд с прозрачной водой под деревом, ветки которого низко склонялись под тяжестью спелых плодов. Едва Тантал наклонял голову, чтобы выпить глоток воды, она тут же уходила вниз. Если он поднимал руку, чтобы сорвать яблоко, то ветки мгновенно уклонялись в сторону. Так и стоял царь, мучимый жаждой, по горло в воде и голодный, хотя аппетитные и сочные плоды медленно раскачивались у его лица… Вот так описывается древний миф муки Тантала.

Периодический закон и периодическая система химических элементов
Все приложенные в этом направлении усилия увенчались открытием периодического закона русским химиком Д.И. Менделеевым (1869 г.).
Справедливости ради необходимо отметить, что в 1863 году Д.А. Ньюлендс — химик и музыкант — предложил гипотезу по размещению химических элементов, имеющую сходную с «менделеевской». Однако он не оформил свои идеи должным образом, а его попытки поиска мистической музыкальной гармонии в предложенной им классификации элементов скомпрометировали сделанное открытие.
В 1869 году появился первый схематический вариант периодической таблицы. Он был опубликован в журнале, которое выпускало Русское химическое общество. Менделеев оповестил всех крупнейших ученых того времени о своем открытии, однако в дальнейшем не переставал корректировать таблицу.
Основная идея менделеевского открытия заключалась в том, что при увеличении атомной массы свойства элементов и их соединений изменяются не беспорядочно, а периодически. По мере возрастания атомной массы периодически встречаются элементы со сходными свойствами. Например после натрия через некоторое количество элементов появляется сходный с ним калий, а золото похоже по своим характеристикам на серебро и медь
Это было принципиально важное открытие, заслуга Д.И. Менделеева заключается именно в установлении периодической зависимости свойств элементов от атомной массы
Его предшественники увлекались изучением линейного изменения свойств, и от них ускользала периодичность, на которую обратил внимание Д.И. Менделеев
Делая доклад в химическом обществе, он не только охарактеризовал естественные системы элементов и возможность применения их свойств, а также предсказал существование еще трех, к тому времени еще неизвестных элементов. Им были даны названия: экасилиций, экабор, экаалюминий. В дальнейшем предсказанные им элементы получили названия галлия, скандия, германия.
По мнению автора открытия, характеристики элементов, занимающих место в одной группе, являются усредненными между свойствами тех, что стоят сверху и снизу.
Конечно, свойства не повторяют своих «одногруппников» полностью. Они немного меняются и содержат какие-то индивидуальные особенности.
Важнее всего то, что Менделеев в основу классификации заложил не один принцип, а два — это атомная масса, а также особенности химических свойств.
Кроме этого, смелые шаги были совершены при включении некоторых элементов в подгруппу вопреки свойствам, которые им в то время приписывали.
Те же места в таблице, для которых автор открытия не нашел представителей, он оставил пустыми.
1871 год был ознаменован мировым открытием — был сформулирован Периодический закон, научным подтверждением которого стало открытие предсказанных элементов в 1875-1876 годах.
Структура таблицы элементов
Для каждого элемента в таблице отведено место (клетка), они четко пронумерованы. Расположение проведено по мере возрастания атомных масс. Все выстроенные элементы были разделены Менделеевым на ряды, начинающиеся со щелочного металла, а заканчивающиеся галогеном (благородные газы в то время не были открыты). Ряды принято называть периодами. Валентность атомов в кислородных соединениях в них увеличивается, металлические свойства элементов и простых веществ уменьшаются, а неметаллические увеличиваются.
Ряды по вертикали имеют название — группы. Представители групп имеют одинаковую высшую валентность, формулы высших оксидов, соединений с водородом, гидроксидов. Их свойства как простых веществ, так и в соединениях сходны.
Периоды бывают малыми и большими. В малых — небольшое число элементов. К ним относятся первый (состоит из 2-х представителей), второй, а также третий (8 элементов).
Прочие периоды: 4-ый и 5-тый (по 18 элементов), 6-той (32), 7-мой (24) — называются большими.
Малые периоды включают элементы только главных подгрупп (А), большие периоды — элементы как главных, так и побочных подгрупп (Б).
В пределах одного периода наблюдается изменение различных характеристик атомов элементов (атомного радиуса, энергии ионизации, электроотрицательности и пр.). Так, слева направо радиус атома уменьшается, а энергия ионизации сродство к электрону, электроотрицательность возрастают. Происходит это в силу того, что в периоде для каждого следующего элемента увеличивается число электронов на внешнем слое и заряд ядра, что приводит к усилению связи электронов внешнего слоя с ядром и к сжатию атома.
Самый первый вариант таблицы Д.И. Менделеев представил в 1869 году, сегодняшний вариант датируется 1871-м годом. В настоящее время существует более 700 различных видов таблицы элементов (периодической системы), основными из которых являются три: краткий, длинный, сверхдлинный. Сверхдлинный вариант содержит выстроенные в таблицу ряды лантаноидов и актиноидов, т.е. включает дополнительные 14 групп, каждая по два элемента. В длинной форме таблицы ряды лантаноидов и актиноидов вынесены за пределы таблицы в виде двух дополнительных строк, которые обычно помещают под таблицей. Короткая форма, помимо вынесения лантаноидов и актиноидов, позволяет расположить четвертый и следующие за ним периоды в 2 строчки (в одной строке располагаются элементы главных подгрупп, во второй — побочных).
«Короткий» вариант:
«Сверхдлинный вартиан» характеризуется тем, что для каждого периода отведена ровно одна строка:
«Длинный» вариант отличается вынесением лантаноидов и актиноидов на отдельное от общей таблицы место.
Слайд 21 Тем временем Г. Эсмарк нашел на острове
Левен (близ берегов Норвегии) тяжелый черный минерал. Образец этого минерала
ученый послал Й. Берцелиусу, который провел тщательный химический анализ. В 1828 году он сообщил о выделении из минерала силиката нового элемента. Тут – то и пригодилось старое название «торий». Минерал же, послуживший источником тория – 2, получил от Й. Берцелиуса название «торит». Когда Й. Берцелиус изучал важнейшие свойства тория, то Ф
Велер обратил внимание на то, что они похожи на свойства элемента, который он легкомысленно оставил без внимания в 1826 году. Но Ф
Велеру суждено было испытать еще горшее разочарование. Через 6 лет знаменитый немецкий ученый и путешественник А. Гумбольдт подарил ему образец пирохлора из Сибири. В нем Ф. Велер нашел торий, как в свое время в норвежском пирохлоре. Торий сыграл с Ф. Велером злую шутку. Й. Берцелиус тщетно пытался выделить металл торий. Долгие годы элемент был известен лишь в виде оксида. Металл удалось получить в 70-х годах 19 века. Так торий стал вторым радиоактивным элементом (после урана), открытым, однако, вне всякой связи с явлением радиоактивности обычным химико – аналитическим методом.
Список химических элементов таблицы Менделеева
- 1 H Водород (а.м. 1,00794)
- 2 He Гелий (а.м. 4,002602)
- 3 Li Литий (а.м. 6,9412)
- 4 Be Бериллий (а.м. 9,0122)
- 5 B Бор (а.м. 10,812)
- 6 С Углерод (а.м. 12,011)
- 7 N Азот (а.м. 14,0067)
- 8 О Кислород (а.м. 15,9994)
- 9 F Фтор (а.м. 18,9984)
- 10 Ne Неон (а.м. 20,179)
- 11 Na Натрий (а.м. 22,98977)
- 12 Mg Магний (а.м. 24,305)
- 13 Al Алюминий (а.м. 26,98154)
- 14 Si Кремний (а.м. 28,086)
- 15 P Фосфор (а.м. 30,97376)
- 16 S Сера (а.м. 32,06)
- 17 Cl Хлор (а.м. 35,453)
- 18 Ar Аргон (а.м. 39,948)
- 19 К Калий (а.м. 39,0983)
- 20 Ca Кальций (а.м. 40,08)
- 21 Sc Скандий (а.м. 44,9559)
- 22 Ti Титан (а.м. 47,9)
- 23 V Ванадий (а.м. 50,9415)
- 24 Cr Хром (а.м. 51,996)
- 25 Mn Марганец (а.м. 54,938)
- 26 Fe Железо (а.м. 55,847)
- 27 Со Кобальт (а.м. 58,9332)
- 28 Ni Никель (а.м. 58,7)
- 29 Cu Медь (а.м. 63,546)
- 30 Zn Цинк (а.м. 65,38)
- 31 Ga Галлий (а.м. 69,72)
- 32 Ge Германий (а.м. 72,59)
- 33 As Мышьяк (а.м. 74,9216)
- 34 Se Селен (а.м. 78,96)
- 35 Br Бром (а.м. 79,904)
- 36 Kr Криптон (а.м. 83,8)
- 37 Rb Рубидий (а.м. 85,4678)
- 38 Sr Стронций (а.м. 87,62)
- 39 Y Иттрий (а.м. 88,9059)
- 40 Zr Цирконий (а.м. 91,20)
- 41 Nb Ниобий (а.м. 92,9064)
- 42 Mo Молибден (а.м. 95,94)
- 43 Tc Технеций (а.м. 98,9062)
- 44 Ru Рутений (а.м. 101,07)
- 45 Rh Родий (а.м. 102,9055)
- 46 Pd Палладий (а.м. 106,4)
- 47 Ag Серебро (а.м. 107,868)
- 48 Cd Кадмий (а.м. 112,41)
- 49 In Индий (а.м. 114,82)
- 50 Sn Олово (а.м. 118,69)
- 51 Sb Сурьма (а.м. 121,75)
- 52 Те Теллур (а.м. 127,6)
- 53 I Йод (а.м. 126,9045)
- 54 Xe Ксенон (а.м. 131,3)
- 55 Cs Цезий (а.м. 132,9054)
- 56 Ba Барий (а.м. 137,33)
- 57 La Лантан (а.м. 138,9)
- 58 Ce Церий (а.м. 140,12)
- 59 Pr Празеодим (а.м. 140,9)
- 60 Nd Неодим (а.м. 144,24)
- 61 Pm Прометий (а.м. 145)
- 62 Sm Самарий (а.м. 150,35)
- 63 Eu Европий (а.м. 151,96)
- 64 Gd Гадолиний (а.м. 157,25)
- 65 Tb Тербий (а.м. 158,92)
- 66 Dy Диспрозий (а.м. 162,5)
- 67 Ho Гольмий (а.м. 164,93)
- 68 Er Эрбий (а.м. 167,26)
- 69 Tm Тулий (а.м. 168,93)
- 70 Yb Иттербий (а.м. 173,04)
- 71 Lu Лютеций (а.м. 174,97)
- 72 Hf Гафний (а.м. 178,49)
- 73 Ta Тантал (а.м. 180,9479)
- 74 W Вольфрам (а.м. 183,85)
- 75 Re Рений (а.м. 186,207)
- 76 Os Осмий (а.м. 190,2)
- 77 Ir Иридий (а.м. 192,22)
- 78 Pt Платина (а.м. 195,09)
- 79 Au Золото (а.м. 196,9665)
- 80 Hg Ртуть (а.м. 200,59)
- 81 Tl Таллий (а.м. 204,37)
- 82 Pb Свинец (а.м. 207,2)
- 83 Bi Висмут (а.м. 208,9)
- 84 Po Полоний (а.м. 209)
- 85 At Астат (а.м. 210)
- 86 Rn Радон (а.м. 222)
- 87 Fr Франций (а.м. 223)
- 88 Ra Радий (а.м. 226)
- 89 Ac Актиний (а.м. 227)
- 90 Th Торий (а.м. 232,03)
- 91 Pa Протактиний (а.м. 231,03)
- 92 U Уран (а.м. 238,02)
- 93 Np Нептуний (а.м. 237,04)
- 94 Pu Плутоний (а.м. 244,06)
- 95 Am Америций (а.м. 243,06)
- 96 Cm Кюрий (а.м. 247,07)
- 97 Bk Берклий (а.м. 247,07)
- 98 Cf Калифорний (а.м. 251,07)
- 99 Es Эйнштейний (а.м. 252,08)
- 100 Fm Фермий (а.м. 257,08)
- 101 Md Менделевий (а.м. 258,09)
- 102 No Нобелий (а.м. 259,1)
- 103 Lr Лоуренсий (а.м. 260,1)
- 104 Rf Резерфордий (а.м. 261)
- 105 Db Дубний (а.м. 262)
- 106 Sg Сиборгий (а.м. 266)
- 107 Bh Борий (а.м. 267)
- 108 Hs Хассий (а.м. 269)
- 109 Mt Мейтнерий (а.м. 276)
- 110 Ds Дармштадтий (а.м. 227)
- 111 Rg Ренгений (а.м. 280)
- 112 Cn Коперниций (а.м. 285)
- 113 Uut Унунтрий (а.м. 284)
- 114 Uuq Унунквадий (а.м. 289)
- 115 Uup Унунпентий (а.м. 288)
- 116 Uuh Унунгексий (а.м. 293)
- 117 Uus Унунсептий (а.м. 294)
- 118 Uuo Унуноктий (а.м. 294)
- 119 Uuе Унуненний (а.м. 316)
- 120 Ubn Унбинилий (а.м. 320)
- 121 Ubu Унбиуний (а.м. 320)
- 122 Ubb Унбибий
- 123 Ubt Унбитрий
- 124 Ubq Унбиквадий
- 125 Ubp Унбипентий (а.м. 332)
- 126 Ubn Унбигексий (а.м. 322)
Другие заметки по химии

























